
Praktikum am Kunsthistorischen Institut in Florenz
Vom 15.10. bis zum 28.10.2023 durften wir, Marie Remmers und Frauke Cornelius, Schülerinnen des Gymnasiums Ulricianum Aurich, ein Praktikum am Kunsthistorischen Institut (KHI) in Florenz
Praktikum am Forschungszentrum Jülich vom 07.10. bis zum 18.10.2019
Von Neele-Marie Hermes und Tamara Magiera
In den Herbstferien wurde uns, Neele-Marie Hermes und Tamara Magiera, die Möglichkeit geboten, ein Praktikum am Forschungszentrum Jülich zu absolvieren. Am Forschungszentrum wird in vielen verschiedenen Bereichen geforscht, unter anderem dem der Neurowissenschaften und der Medizin. Während der zwei Wochen waren wir am Institut für Neurowissenschaften und Medizin 2 (INM-2), wovon wir berichten wollen.

Das INM ist in 11 Untereinheiten unterteilt. Diese beschäftigen sich zwar übergeordnet mit dem Gehirn, jedoch hat sich jedes Institut auf ein bestimmtes Forschungsgebiet spezialisiert. Das INM-2 untersucht die molekulare Organisation des Gehirns. Im Laufe unseres Praktikums konnten wir auch einen Einblick in andere Institute des INM erhalten.
Der erste Arbeitstag begann um 8:00 Uhr mit einer Einführung in die bildgebenden Verfahren, die am INM-2 genutzt werden. Diese sind das CT (Computertomographie) und das PET (Positronen-Emissions-Tomografie). Das PET ist ein bildgebendes Verfahren der Nuklearmedizin. Es werden Schnittbilder von lebenden Organismen erstellt, indem die Verteilung einer radioaktiven Substanz im Organismus sichtbar gemacht wird. Um ein Bild zu erstellen, wird ein radioaktiver Tracer injiziert. Dieser sendet Positronen aus, welche, wenn sie auf ein Elektron treffen, zu zwei Gamma-Quanten reagieren. Diese Gamma-Quanten werden auch Photonen genannt und treffen auf den ringförmigen Detektor des PET-Geräts. In der Folge entsteht ein Bild.
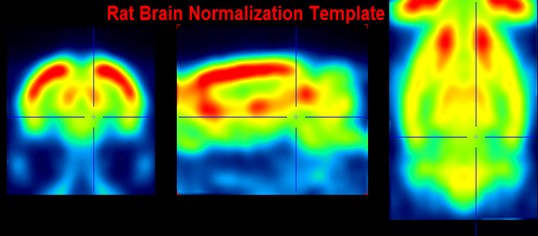
Hier sind drei verschiedene Schnittmethoden erkennbar: auf dem ersten Bild die koronale, folglich die sagittale und zuletzt die transversale Methode.
Es war uns aufgrund unseres Alters leider nicht möglich, bei Tier-PET-Scans dabei zu sein. Jedoch durften wir bei den vorbereitenden OPs zusehen. Dort wurden Ratten verwendet, die von externen Züchtern geliefert wurden.
Wir konnten zwei Operationen miterleben, die ein Tier vor einem Scan durchläuft. Bei einer der beiden wurde das mit Isofluran betäubte Tier auf die PET-Messung vorbereitet, indem am Bregma in den Schädel zwei Löcher gebohrt wurden. In die eine Gehirnhälfte wurde eine Lösung gespritzt, welche eine Entzündung am Gehirn hervorruft, und in die andere zur Kontrolle Natriumchloridlösung (NaCl-Lösung). Durch die Entzündung, welche hervorgerufen wird, wird das LGS (Lennox-Gastaut-Syndrom) auslöst.
Im weiteren Verlauf, welchem wir aufgrund der Verwendung von radioaktivem Material nicht mehr beiwohnen durften, wird dem Tier ein Tracer injiziert. Der Tracer ist ein radioaktiv markierter Stoff, der an die Entzündung bindet und somit unter dem PET zu sehen ist. Hierbei wird ein Unterschied zwischen beiden Gehirnhälften sichtbar, da in die „Kontrollhälfte“ mit NaCl-Lösung kaum etwas von dem Tracer gebunden hat.
Die zweite OP des Tieres kann als Nachbereitung der ersten betrachtet werden; hier wird nicht steril gearbeitet, da das Ableben des Tieres nach einer weiteren Operation unvermeidbar ist. Das Blut des Tieres wird vermehrt untersucht, vor allem im Hinblick auf die Auswirkungen der ersten OP.
Da im INM-2 nur mit Ratten- und Mäusegehirnen gearbeitet wird, lernten wir auch den speziellen Umgang mit diesen, aber auch mit Tieren als Forschungsobjekten, näher kennen.
Die Rattengehirne welche untersucht werden, werden bei -80°C gelagert und bei -18°C im Cryostaten in 20 µm dünne Schnitte geschnitten. Mit diesen Schnitten kann man mithilfe einer Färbung verschiedene Dinge sichtbar machen. Wir lernten die Nisslfärbug mit Kresylviolett kennen. Hierbei werden die Zellkörper, Zellkerne und die enthaltenen Nisslschollen (Stapel des rauen Endoplasmatischen Reticulums) eingefärbt. Das Ergebnis der Färbung ist unter dem Mikroskop, aber auch nur mit bloßem Auge, erkennbar.
In diesem sagittalen Schnitt eines Rattengehirns ist das Kleinhirn im unteren Bereich gut zu erkennen. Die markante Struktur zeigt sich an den Rändern stark blau-violett eingefärbt aufgrund der hohen Dichte an Zellen.

Des Weiteren lernten wir die Patch-Clamp-Methode für die Untersuchung der neuronalen Verarbeitung auf der Ebene einzelner Zellen kennen, mit dem Ziel, die Verbindungen und Interaktionen der Neuronen im Gehirn nachvollziehen zu können.
Es war für uns sehr spannend zu sehen, wie mithilfe dieser Methode die Aktionspotenziale der Neuronen im Gehirn einer Maus untersucht werden können.

Jedoch müssen die Gehirnschnitte sehr frisch sein, damit eine Messung überhaupt möglich ist. Hierfür wird das Gehirn direkt nach dem Entnehmen in eine Lösung eingelegt, welcher fortwährend Sauerstoff zugeführt wird. Die Kette wird nicht unterbrochen, sodass auch die Schnitte in dieser Lösung angefertigt werden.
Mit feinen Glaskapillaren, welche einen Durchmesser von 1 bis 3 μm haben, wird ein einzelnes Neuron anvisiert und von außen eine Elektrodenspannung angelegt, sodass eine Reaktion der Zelle beobachtet werden kann. Die Spannung führt zur Depolarisation oder Hyperpolarisierung der Zelle.
Es ist bekannt, dass Neuronen auf elektrische Impulse reagieren. In einer Nervenzelle liegt beim Ruhepotenzial eine Spannung von ungefähr – 60 mV vor. Legt man von außen eine Spannung an, wird dadurch ein Signal an das Neuron gesendet. Die Spannung überschreitet nun einen bestimmten Wert, auch Schwellenspannung genannt. Ein Aktionspotenzial entsteht, wobei die Zelle zunächst depolarisiert wird. In dieser Phase steigt die Spannung stark an und ein Ausschlag ist auf dem Oszilloskop sichtbar. Dieser verläuft immer gleich. Verstärkt man die von außen angelegte Spannung, werden mehrere Aktionspotenziale ausgelöst; deren Stärke nicht zunimmt.
Dadurch, dass mehrere Zellen gleichzeitig untersucht werden können, wird die Kommunikation der Neuronen untereinander nachvollzogen. So kann z.B. bei künstlicher Anlegung einer Spannung an einem Neuron bei dem zweiten untersuchten Neuron ebenfalls ein Aktionspotenzial gemessen werden. Das erregte Neuron hat somit das zweite untersuchte Neuron erregt und die Neuronen sozusagen miteinander kommuniziert.
Da das Forschungszentrum Jülich international bekannt ist, arbeiten dort Wissenschaftler aus vielen verschiedenen Ländern, um in spezialisierten Themen ihre Forschung voran zu bringen. Dadurch wurde auch uns die Möglichkeit gegeben, Einblicke in diese zu erhalten.
Die Verständigung in diesen Fachgruppen fand immer auf Englisch statt, was uns doch recht leicht fiel, besonders da bestimmte Fachbegriffe in allen Sprachen dieselben sind.
Während des Praktikums waren wir im Gästehaus des Forschungszentrums untergebracht, welches uns jeweils ein Zimmer in einer Wohngemeinschaft gestellt hatte. Wir haben nach der Arbeit dort viel Zeit verbracht, da das regnerische Herbstwetter unseren Plänen, die Stadt Jülich zu erkunden, leider einen Strich durch die Rechnung machte. Einen Ausflug nach Aachen haben wir trotz des schlechten Wetters unternommen.

Das Praktikum am Forschungszentrum Jülich hat uns eine einmalige Chance geboten, hinter die Kulissen der Hirnforschung zu blicken. Wir nehmen daraus viel für unsere Zukunft mit.
Wir wollen uns abschließend beim Forschungszentrum Jülich und den Auricher Wissenschaftstagen herzlich bedanken und hoffen, dass auch in den nächsten Jahren Schülern und Schülerinnen, so wie uns, eine solch einzigartige Möglichkeit geboten werden kann.

Vom 15.10. bis zum 28.10.2023 durften wir, Marie Remmers und Frauke Cornelius, Schülerinnen des Gymnasiums Ulricianum Aurich, ein Praktikum am Kunsthistorischen Institut (KHI) in Florenz
Im Rahmen der Auricher Wissenschaftstage hatten wir, Jana Wegner, Helena Brokamp, Lan Chi Nguyen und Fabiola Paulat, die einzigartige Möglichkeit am Anfang der Sommerferien 2023

Praktikumsbericht Max-Planck-Institut für Immunbiologie und EpigenetikIm Rahmen der Auricher Wissenschaftstage hatten wir, Okko Determann und HannoLüpkes, die einzigartige Gelegenheit, vom 16. bis zum 27. Oktober

Praktikum am CeTPD (Centrer for Targeted Protein Ddegradation) Von Johnny Nguyen Über den Kölner Flughafen erreichte ich am 16.10. 2023 die schottische Hauptstadt Edinburgh, die

Dank der Auricher Wissenschaftstage hatten wir, Johanna Dahl und Hanna Windau, die einzigartige Möglichkeit, während der Sommerferien 2023 ein zweiwöchiges Praktikum am Centre for Targeted

von Keno Liebermann und Keno Nieland Vom 16.10 bis zum 27.10 haben wir, Keno Liebermann und Keno Nieland, durch die AuricherWissenschaftstage die Möglichkeit bekommen,
 Gymnasium Ulricianum Aurich Europaschule
Gymnasium Ulricianum Aurich Europaschule