Im Rahmen der Auricher Wissenschaftstage hatten wir, Okko Determann und Hanno
Lüpkes, die einzigartige Gelegenheit, vom 16. bis zum 27. Oktober 2023, ein
Praktikum am Freiburger Max-Planck-Institut für Immunbiologie und Epigenetik
absolvieren zu dürfen.
Das Max-Planck-Institut in Freiburg ist eine Forschungseinrichtung der
Max-Planck-Gesellschaft, die sich mit den zwei Schlüsselbereichen der modernen
Biologie befasst: Immunbiologie und Epigenetik.
Immunbiologie beschäftigt sich mit dem Studium des Immunsystems, das eine
komplexen Abwehrmechanismus des Körpers gegenüber Krankheitserregern, wie
Bakterien, Viren und Parasiten, darstellt. Sie erforscht die Struktur, Funktion und
Regulation der verschiedenen Komponenten des Immunsystems, einschließlich der
Zellen und Moleküle, die an der Immunantwort beteiligt sind. Ziel der Forschung in
diesem Bereich ist es, das Verständnis der Immunreaktionen zu vertiefen, um
Krankheiten besser zu verstehen, vorzubeugen und zu behandeln.
Der Fokus des Instituts liegt auf der Forschungsrichtung der Epigenetik, welche sich
auf Veränderungen in der Genexpression bezieht, die nicht auf Abwandlungen in der
DNA-Sequenz selbst zurückzuführen sind. Diese Veränderungen können durch
Umweltfaktoren beeinflusst werden und haben Auswirkungen darauf, welche Gene
aktiviert oder deaktiviert werden. Epigenetische Mechanismen umfassen
DNA-Methylierung, Modifikation von Histonen und nicht-kodierende RNA. Die
Epigenetik spielt eine entscheidende Rolle bei der Regulation von Zellentwicklung,
Differenzierung und Antwort auf Umweltreize. Sie trägt auch dazu bei, das
Verständnis von Krankheiten, einschließlich Krebs und neurologischen Störungen,
zu vertiefen und potenzielle Ansätze für therapeutische Interventionen zu entwickeln.
Im Institut sind derzeit über 300 Mitarbeiter aus 40 Nationen in 11
Forschungsgruppen tätig, die auf aktuellste wissenschaftliche Infrastruktur
zurückgreifen können. Durch den multinationalen Charakter der Einrichtung findet
die Kommunikation hier primär auf Englisch statt. Auch wir traten im Zeitraum
überwiegend auf Englisch mit den Forscherinnen und Forschern in Kontakt.
Während unseres zweiwöchigen Aufenthaltes besuchten wir das Labor der
Forschungsgruppe unter der Leitung von Prof. Jenuwein, wohnten überdies aber
auch einer institutsübergreifenden Vorlesung einer chinesischen Referentin bei und
konnten Einblicke in die weiteren strukturellen Einblicke des Instituts erhalten.Mit Nicholas Shukeir, dem kanadischen Labormanager, wurde uns ein erfahrener
und offener Mentor zur Seite gestellt. Durch seine Anleitung und durch die Hilfe des
Laborpersonals gelang es uns, durch selbst durchgeführte Experimente mit
verbreiteten biologischen Verfahren, einen tiefgründigen Einblick in den Arbeitsalltag
eines Laboranten zu generieren.
Das Praktikum begann mit einer gründlichen Einführung, die eine
Sicherheitseinweisung, die Präsentation der Forschungsziele sowie die Vorstellung
der Labormitarbeiter unserer Abteilung umfasste.
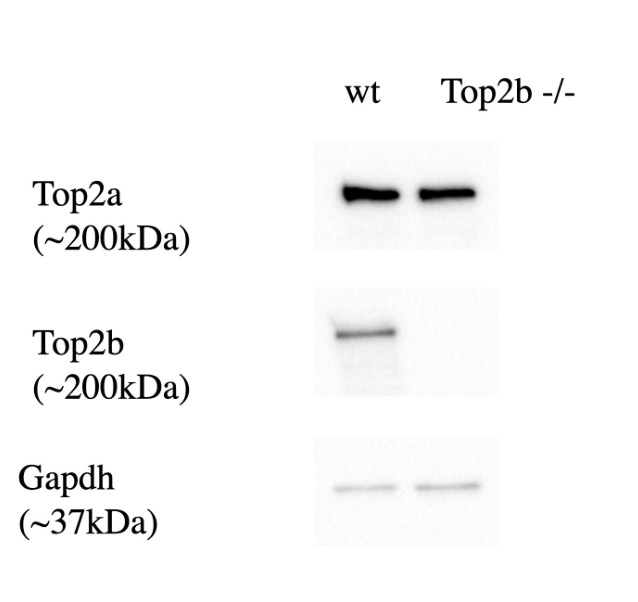
Unser erstes Experiment war die Durchführung eines sogenannten Western
Blottings. Hierbei handelt es sich um eine Reaktion, welche den Nachweis von
spezifischen zuvor aus Zellen oder Geweben extrahierten Proteinen oder
Proteinkomplexen ermöglicht. Wir untersuchten in einem Vergleich die Anwesenheit
unterschiedlicher Proteine in einem Wildtyp und einer genetisch veränderten
Variante der Fruchtfliege (Drosophila).


(Übertragen des Gels auf Membran) (Versuchsaufbau bei Stromfluss)
In einem ersten Teilschritt führten wir eine Gelelektrophorese durch. Dabei
pipettierten wir unser Probenmaterial auf ein Elektrophoresegel, an welches
anschließend eine elektrische Spannung angeschlossen wurde. Je nach Größe der
jeweiligen Proteine wandern diese schneller oder langsamer auf dem Gel, wodurch
sie sich in unterschiedliche Bereiche auf dem Gel separieren.
Nachfolgend transferierten wir die separierten Proteine auf eine
Nitrozellulose-Membran. Nachdem wir durch Zufügen einer Blockierlösung dieAusbildung unspezifischer Bindungen verhindern konnten, fügten wir der Membran
erst einen, für das von uns betrachtete Protein Top2b, spezifisch bindenden
primären Antikörper hinzu. Nach einem Waschvorgang und dem Zugeben eines
sekundären Antikörpers konnten wir mithilfe eines Detektionsverfahrens die Banden
der betreffenden Proteine auf der Membran sichtbar machen.
Durch den Versuch, der sich über zwei Tage erstreckte, konnten wir nachweisen,
dass in der genveränderten Variante das Protein Top2b nicht auftritt, wohl aber in
der Ursprungsform

(Membran im Waschvorgang und abschließende Ergebnisse)
Die weiteren Tage nutzten wir unter vielen anderen Experimenten für die
Durchführung von PCR-Reaktionen zum Genotyping der Drosophila Fliegen.
PCR werden durchgeführt, um geringe Mengen DNA zu vervielfältigen, damit
genügend Material für verschiedene genetische Tests vorhanden ist.
Wir führten das Polymerase-Kettenreaktion (PCR)-Verfahren durch, indem wir
zunächst die Ziel-DNA-Proben aus zwei verschiedenen Klonen extrahierten und
isolierten. Vorab wurde an den Klonen mithilfe des CRISPR-Cas9-Verfahrens ein
spezifischer DNA-Abschnitt eingefügt.
Das CRISPR-Cas9-Verfahren wird angewendet, um präzise Genmodifikationen zu
erzeugen, indem die Cas9-Endonuklease gezielt DNA schneidet und die natürlichen
Reparaturmechanismen des Organismus nutzt, um spezifische genetische
Veränderungen einzuführen.
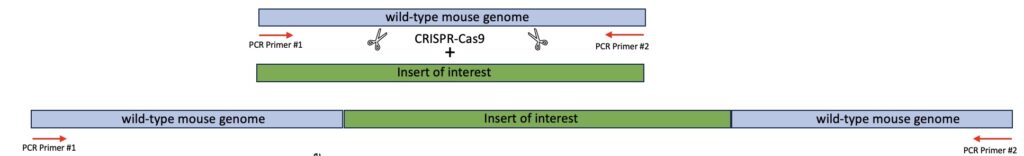
Schematische Darstellung einer PCR Reaktion
Die Reaktionsmischung, die wir vorbereiteten, enthielt DNA-Polymerase, Nukleotide
und spezifische Oligonukleotid-Primer. Die Proben wurden in einem Thermocycler
zyklisch erhitzt und abgekühlt, um die Denaturierung der DNA, die Hybridisierung
der Primer und die synthetische Reaktion durch die Polymerase zu ermöglichen.
Durch mehrere Zyklen erhielten wir eine exponentielle Amplifikation der Ziel-DNA. Im
Anschluss führten wir eine Gel-Elektrophorese durch und verglichen schließlich die
Ergebnisse. Dabei betrachteten wir den Marker sowie die genotypischen Varianten
Wildtyp, Klon 1 und Klon 2, um Unterschiede in den Banden festzustellen.
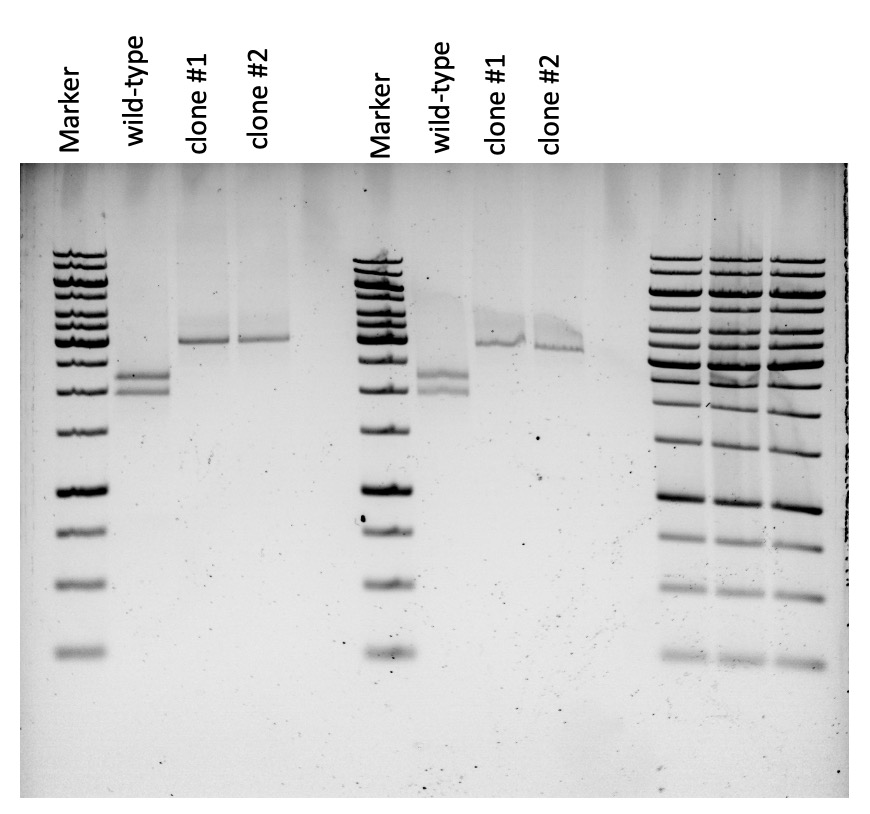
(Ergebnis der Gel-Elektrophorese)
In der zweiten Woche besuchten wir das Fliegenlabor, in dem an Drosophila
geforscht wird. Diese eignen sich besonders gut für die Forschung in der Epigenetik,
da ihre kurzen Lebenszyklen, genetische Konservierung und einfache Haltung es
ermöglichen, präzise Erkenntnisse über epigenetische Mechanismen zu gewinnen.
Im Labor konnten wir unter Anleitung von Karolina Barucka und Mrinal Chayengia
auf ein großes Portfolio von unterschiedlichsten Fruchtfliegenklonen zurückgreifenund diese hinsichtlich ihrer unterschiedlichen Merkmale untersuchen und unter dem
Mikroskop einer genaueren Beobachtung unterziehen. Nach etwas Übung gelang es
uns beiden sogar, aus einem Haufen vieler Individuen, Exemplare nach ihrem
Geschlecht und Alter zu sortieren. Mit Hilfe mikroskopischer Fotos dokumentierten
wir diese Prozesse.

(Fliegenklon mit modifizierten roten Augen)
Abschließend führten wir die Immunfluoreszenz (IF) mit Karolina durch, um die
räumliche Verteilung und Lokalisierung von Proteinen oder anderen Molekülen in
den Zellen der Fruchtfliegen zu visualisieren.
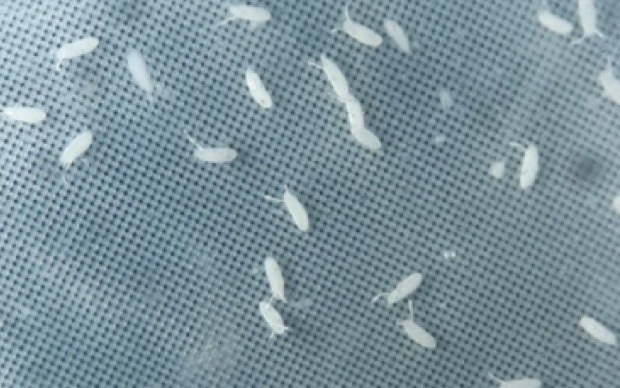
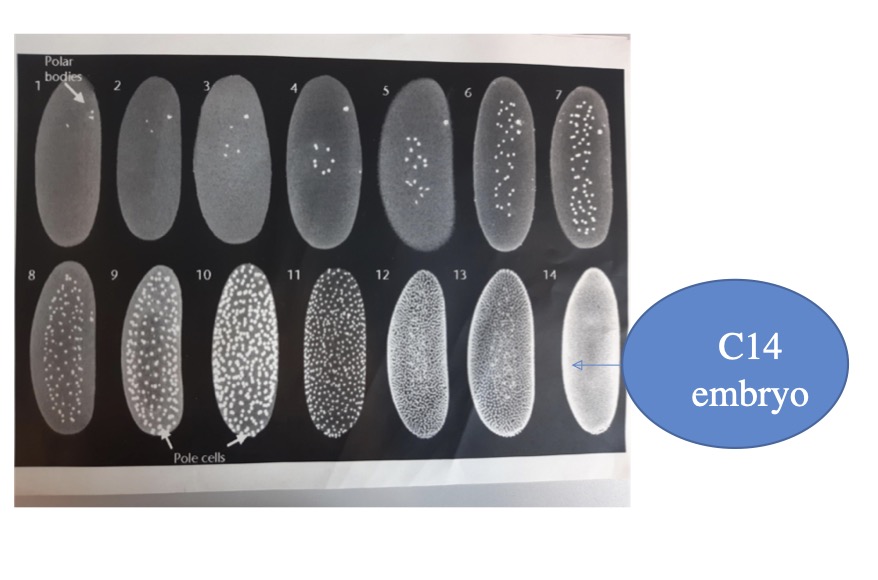
Zuerst sammelten wir Fruchtfliegenembryos zu einem spezifischen Zeitpunkt, etwa
zwei Stunden nach der Befruchtung, mit dem Ziel C14-Embryos zu isolieren, die
nach exakt 14 Zellteilungen entstanden sind. Die äußere Anordnung der Zellen beim
C14-Embryo war entscheidend. Nach der Reinigung der Embryos, die mehrere
Lösungen durchliefen, führten wir die Immunfluoreszenz (IF) durch.(C-14 Embryos).

Ablauf der Zellteilungen Hanno am Mikroskop)
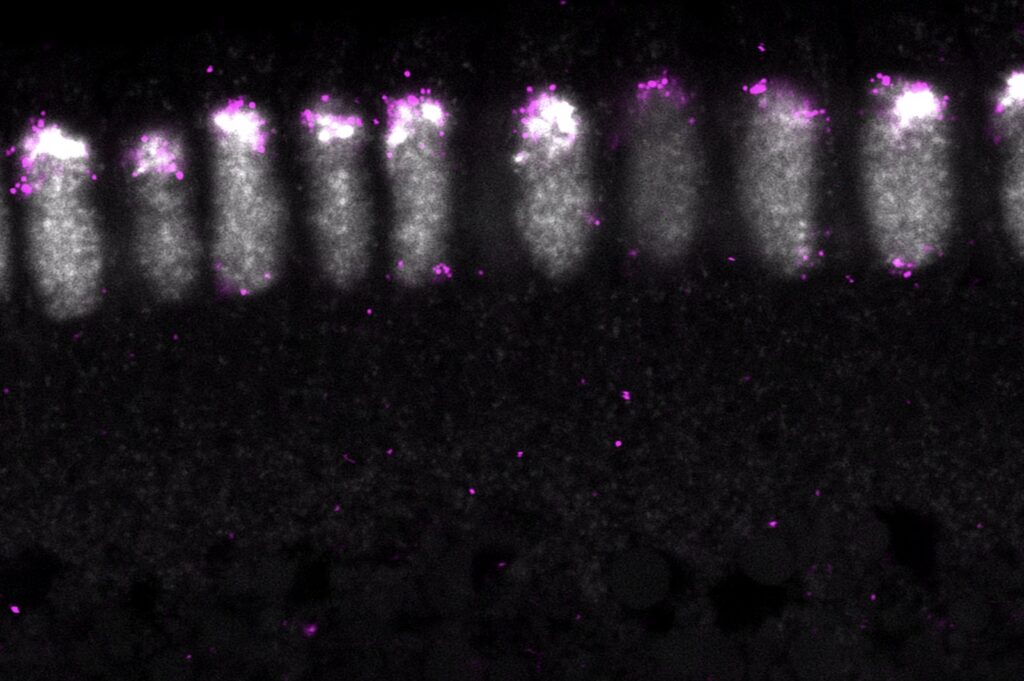
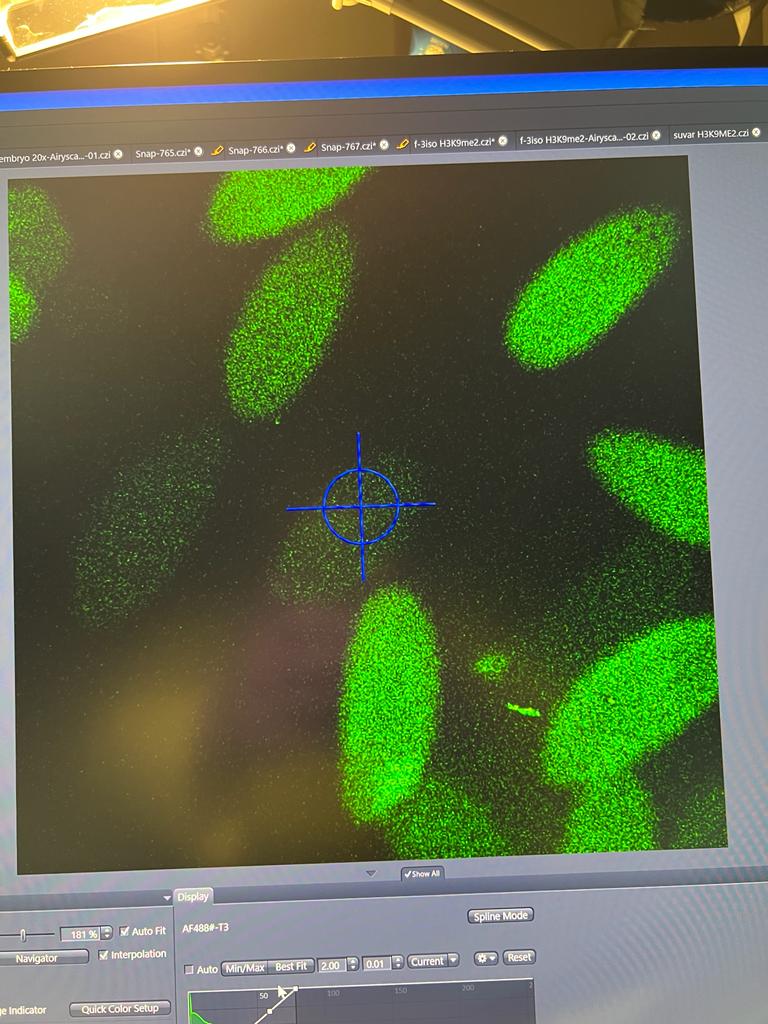
Hierbei kam der Farbstoff DAPI zum Einsatz, der in der Fluoreszenzmikroskopie die
DNA markiert und somit die Struktur unter dem Mikroskop sichtbar macht. Durch
die Zugabe spezifischer Antikörper wurden die von uns untersuchten Proteine
sichtbar und wir konnten ihre räumliche Verteilung unter Verwendung bestimmter
Lichtwellen dokumentieren.
Unser Ergebnis
Die Mikroskopie und Analyse, insbesondere die Arbeit mit einem
Hochauflösungs-Fluoreszenz-Mikroskop, eröffnete erstaunliche Einblicke in die
Aktivität der Gene. Die Analyse von Aufnahmen wurde zu einer fesselnden
Erfahrung.
Insgesamt lieferte der Praktikumsalltag nicht zuletzt fachliche Einblicke in den
Forschungsalltag und den hierbei eingesetzten Methoden, sondern förderteaußerdem relevante Aspekte wie die Kommunikation bilingualer Natur oder
Eigenverantwortung in einem fremden Umfeld. Zusammenfassend können wir die
gewonnenen Eindrücke als sehr positiven Einfluss auf unsere “Soft-Skills” werten.
Abschließend möchten wir uns noch einmal herzlich bei den Organisatoren der
Auricher Wissenschaftstage und dem Max-Planck-Institut für Immunbiologie und
Epigenetik in Freiburg für dieses lehrreiche Praktikum bedanken. Die in jederlei
Hinsicht erworbenen Erfahrungen werden gewiss nachhaltigen Einfluss auf unseren
Werdegang nehmen.

von links: Nicholas Shukeir, Mrinal Chayengia, Hanno Lüpkes, Okko Determann, Derek Atkinson, Karolina Barucka
 Gymnasium Ulricianum Aurich Europaschule
Gymnasium Ulricianum Aurich Europaschule
